心血管新藥研發如何彎道超車?一文讀懂美國近10年態勢
1 改良型新藥迎來“注冊申報的春天”
2020年7月1日起,化學藥品、生物制品注冊分類正式按照NMPA發布的《化學藥品注冊分類及申報資料要求》和《生物制品注冊分類及申報資料要求》實施。
對于其中2類新藥——改良型新藥如何開展臨床試驗?CDE在2020年12月31日關于發布《化學藥品改良型新藥臨床試驗技術指導原則》的通告中亦予以明確的路徑指導。
在原研已有研發數據的基礎上進行處方、劑型、給藥途徑、適應癥等方面的優化,針對未被滿足的臨床需求,降低成本、縮短臨床研發周期進行注冊申報,改良型新藥正在成為我國注冊申報的熱點領域。
2 美國改良型新藥與創新藥發展態勢
1) 藥物研發技術發展趨勢
由美、歐、日主流市場制藥公司的發展歷程可知,創新藥的研發需要人才、資金、技術以及時間的積累,多數國際巨頭企業都經歷了從普通仿制藥、大宗仿制藥(全球化仿制藥)、高端仿制藥、改良型新藥到創新藥幾個階段。
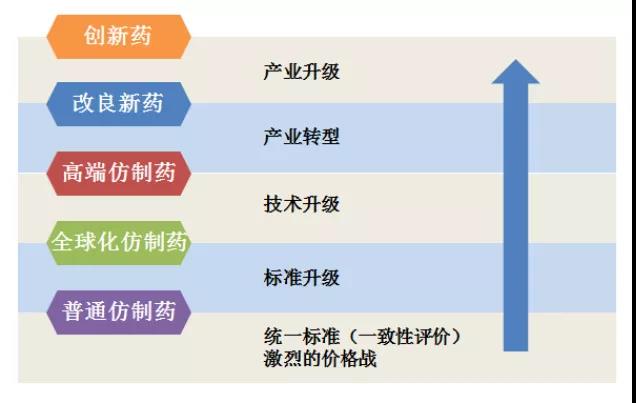
圖1 化學制藥產品發展趨勢
在美國,505法案(即《聯邦食品、藥品、化妝品法案》第5章第505分章)中,化學藥品可分為以下3種申請類別,其中NDA包括505(b)(1)和505(b)(2),ANDA為505(j)。

圖2美國505(b)法案藥品分類 (數據來源:美國FDA網站數據整理)
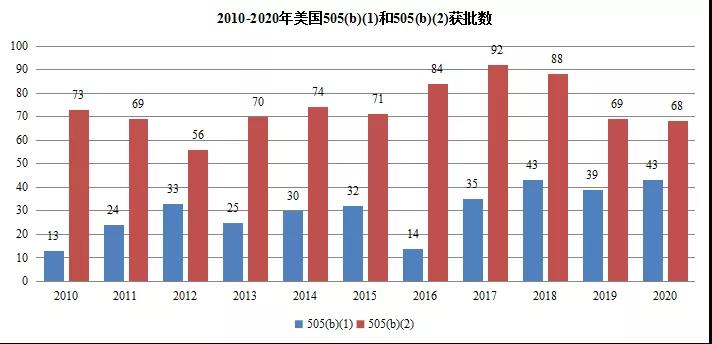
在美國市場,改良型新藥發展速度與創新藥同步,已成為美國新藥市場主力,505(b)(2)申請獲批產品數量不斷攀升,上市后銷售額引人注目。近10年美國通過505(b)(2)申請獲批的產品快速增加,2020年申請獲批的產品達68個,505(b)(2)途徑申報的新藥漸成研發主力,改良新藥已成藥物研發的主力。
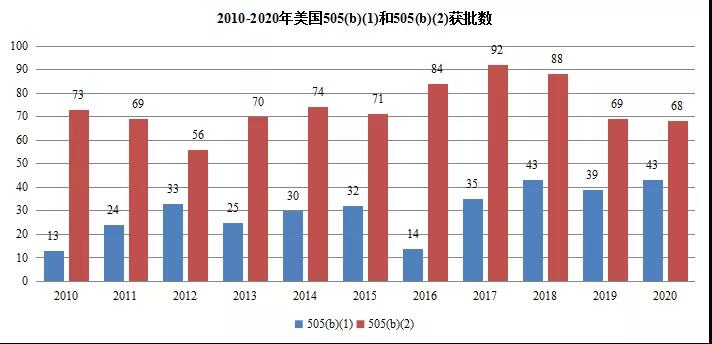
圖3 近10年化藥不同申報類型數量 (數據來源:美國FDA網站數據整理)
2) 心血管藥物改良型新藥發展趨勢
在心血管領域中,2010-2020年美國FDA共批準NDA 55個,其中505(b)(1)產品13個, 505(b)(2)產品42個,包括復方制劑10個(新復方9個+新分子實體復方1個)、新活性成分4個、新劑型13個(新劑型12個+新活性成分新劑型1個)、新制劑11個,其他2個。
總體而言,在心血管領域的改良型品種中,以復方制劑、新劑型、新制劑為主。
表1 2010-2020年美國FDA批準的心血管領域的改良型品種類別
(數據來源:美國FDA網站數據整理)
經查詢美國審評綜述,本領域獲批的24個新劑型/新制劑中,4個品種為注射劑,20個品種為口服制劑,總體而言仍然以口服制劑為主。不同品種改良優勢匯總如下,主要改良優勢為改善依從性(可用于吞咽困難患者)和增加兒童制劑為主。
表2 2010-2020年美國FDA批準的心血管領域改良型新藥的主要優勢(新劑型/新制劑)
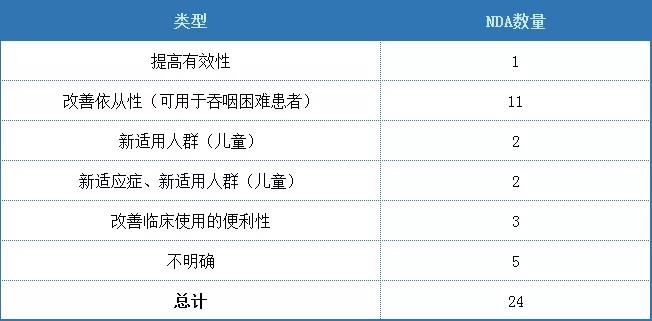
(數據來源:美國FDA網站數據整理)
主要品種信息如下表所示,其中高血壓和心力衰竭藥物12個,高血脂藥物3個,肺動脈高壓藥物2個,其他品種4個。
表3 2010-2020年美國FDA批準的心血管領域的改良型新藥品種(新劑型/新制劑)
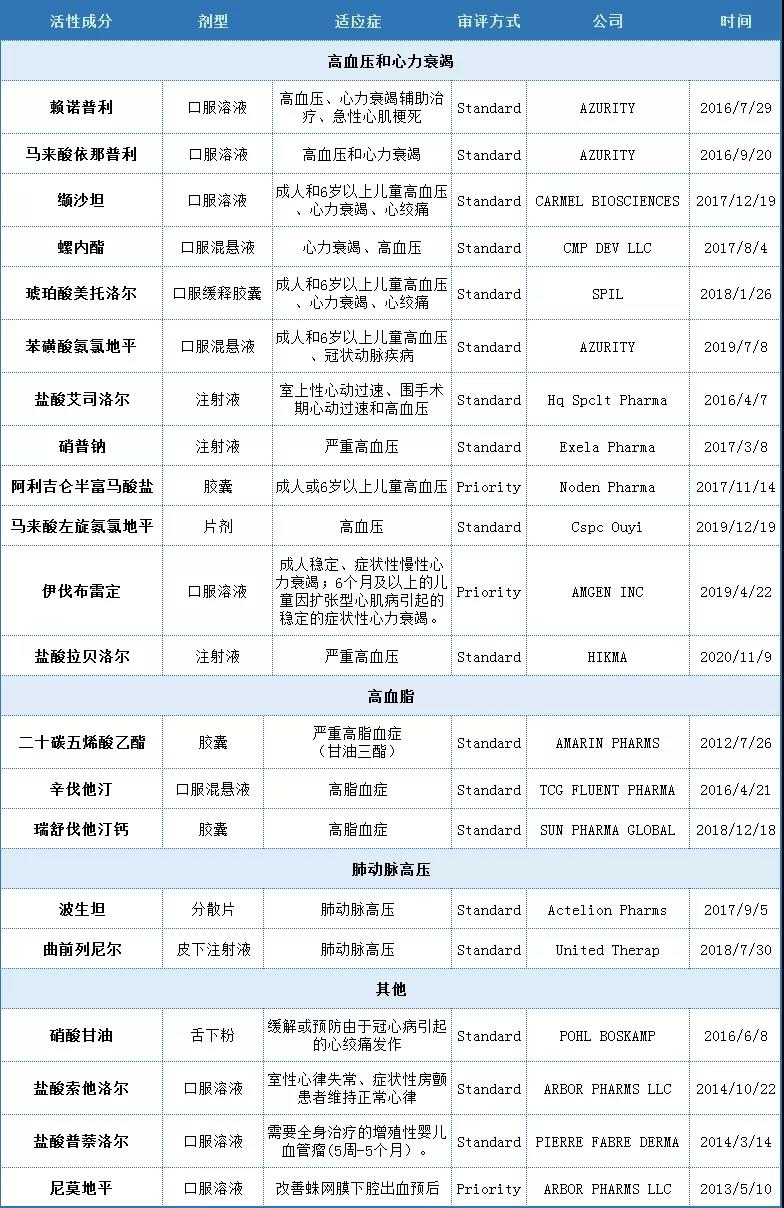
(數據來源:美國FDA網站數據整理)
由此可見,在心血管領域的改良型新藥主要以開發新復方和新劑型/新制劑為主。新劑型/新制劑的主要臨床改善為可用于吞咽困難患者和擴大適用人群(兒童)。
3 重點品種的立項和開發策略分析
本文篇幅有限,不能一一贅述,以下選取幾個代表性品種分析其立項和開發策略,以期為我們開發心血管領域的改良型品種提供參考:
(1)伊伐布雷定口服溶液-新適應癥、新適用人群(兒童)
-
立項背景與臨床需求
Servier和美國被許可人Amgen公司開發了首個選擇性、特異性竇房結If通道阻滯劑鹽酸伊伐布雷定片和口服溶液,用于成人穩定、癥狀性慢性心力衰竭,降低因心衰惡化而住院的風險;伊伐布雷定減慢心率的同時不影響心肌收縮力和心臟傳導。在2019年4月,伊伐布雷定口服溶液被批準用于治療6個月及以上的兒童因擴張型心肌病引起的穩定的癥狀性心力衰竭。此外,對于不能吞咽片劑的患者,可以使用口服溶液劑。
美國FDA的網站未收載本品的審評綜述,因此開發內容主要參考美國說明書。
-
上市后市場表現
本品2019年獲批,暫無銷售數據。
從我國片劑市場表現來看,2019年銷售額約為6011萬元,同比增長+190.81%。市場處于快速增長期。口服溶液劑是片劑的補充,可以更好地覆蓋全部人群,滿足不同的臨床需求。
-
開發成本
非臨床試驗:未開展新的非臨床研究內容,主要參考片劑;
臨床試驗:開展了1項生物等效性試驗和1項兒童PKPD臨床試驗。
BE試驗:相同劑量的口服溶液和片劑口服后,伊伐布雷定和S18982(本品的主要活性代謝產物為N-去甲基化衍生物)生物等效。
PKPD臨床試驗:由于伊伐布雷定的其他臨床試驗已經顯示,對于擴張型心肌病(DCM)具有改善作用,因此,可以合理推測本品對兒童擴張性心肌病引起的穩定的癥狀性心力衰竭也有效。在有癥狀DCM的兒童中進行的多中心、隨機、雙盲、安慰劑對照試驗中評估了Corlanor對心率的影響。70例擴張型心肌病和有癥狀的慢性心力衰竭兒童患者中,基于體重滴定劑量,評估了伊伐布雷定和S18982的藥代動力學。結果顯示,在小兒年齡段和成年人中,暴露與心率降低之間的關系相似。小兒患者基于維持劑量后,伊伐布雷定和S18982的穩態暴露與給予5 mg BID的成年心力衰竭患者的暴露相似。
(2)琥珀酸美托洛爾緩釋膠囊-可用于吞咽困難的患者
琥珀酸美托洛爾緩釋膠囊是Sun Pharma公司開發的505(b)(2)產品,用于高血壓、心力衰竭和心絞痛。部分安全性和有效性內容參考了RLD產品Toprol-XL(琥珀酸美托洛爾緩釋片)相關內容。
2018年1月26日美國FDA批準本品上市,商品名為Kapspargo Sprinkle,規格為25mg、50mg、100mg和200mg。
-
立項背景與臨床需求
對于所有批準的適應癥,本品均為每天單次給藥。RLD Toprol-XL®為薄膜包衣片劑(刻痕片),但對于吞咽困難的患者不適用。琥珀酸美托洛爾緩釋膠囊不僅可以整吞,而且如果患者吞咽困難,可以打開膠囊后,將其內容物灑在柔軟的食物上或通過鼻胃管給藥。
-
開發成本
CMC:多顆粒系統,采用蔗糖微丸上藥。
非臨床藥理毒理學:未開展新的非臨床藥理毒理學研究。
臨床研究:開展了1項開放標簽的相對生物利用度研究和1項食物影響研究。
開展了200 mg Toprol-XL 緩釋片和200 mg緩釋膠囊的生物等效性試驗。Cmax和AUCinf(90%置信區間)的幾何平均值分別為95.6(91.3,100)和88.3(80.9,96.4)。結果表明,服用緩釋膠囊后的暴露與服用Toprol-XL片劑后的暴露相似。25、50和 100 mg膠囊生物等效性試驗豁免。
1項食品影響研究表明,高脂肪、高熱量的膳食不會改變琥珀酸美托洛爾緩釋膠囊的暴露量。另外,與服用完整的膠囊相比,打開膠囊后,與軟食品一同服用內容物不會改變暴露。
另外,體外研究顯示,將膠囊內容物灑在各種pH值的軟食品至少60分鐘未降解。當經過鼻胃管給藥時,沒有藥物保留在導管材料上。因此,沒有必要進行體內研究來證明給予整個膠囊與通過鼻胃管給藥的相對生物利用度。
(3)尼莫地平口服溶液-改善臨床使用的便利性
尼莫地平口服溶液由Arbor Pharmaceuticals開發,用于改善蛛網膜下腔出血(SAH)預后,如缺血性神經障礙。部分安全性和有效性內容參考了Nimotop軟膠囊(1998年獲批)的相關內容。
2013年5月10日美國FDA批準本品上市,商品名為NYMALIZE,規格為60 mg/10 mL 預充式,審評方式為優先審評,此外,cortellis數據庫顯示,FDA授予了本品Fast Track和Orphan Drug資格。
-
開發背景和臨床需求
尼莫地平是唯一批準用于改善SAH預后的藥物,安全性和有效性充分。但在尼莫地平軟膠囊Nimotop的說明書中,對于吞咽困難患者的標準做法為使用注射器吸取膠囊填充物后經鼻飼管給藥,但存在錯誤靜脈注射的可能性,靜脈注射后可能會導致死亡。為了方便臨床使用,ARBOR公司開發了尼莫地平口服溶液,可直接用于可吞咽的患者或經鼻飼管或胃管給藥,而無需使用注射劑吸取,有助于消除用藥錯誤,規范臨床使用。
-
開發成本
總體而言,本品的開發成本相對較低,僅開展一項非臨床研究,未開展臨床研究。
非臨床研究:由于6種雜質限度高于閾值,因此開展了一項非臨床研究評估雜質和降解產物的安全性。Sprague-Dawley大鼠為期14天經口給藥(最高120mg/kg/天)的毒理學研究中,大鼠給予新制和久制樣品后,毒理學表現相似。考慮到尼莫地平臨床使用時間有限,因此兩周的毒理學研究評價雜質的安全性是充分的,與人類最大日劑量相比,提供了2-7倍的安全閾值。未開展其他非臨床藥理和毒理學研究。
臨床研究:未開展新的臨床研究。主要依據:1)與已獲批的膠囊內容物等效;2)無影響生物利用度的非活性成分。
其他特殊說明書:根據美國說明書,尼莫地平口服溶液暫未批準兒童用法用量,但本品是我國《首批鼓勵研發申報兒童藥品清單》品種,規格為3mg/ml,關注兒童藥品的企業可以進一步開發本品,開發擴大適用人群,開發兒童專用產品。
4 小結和建議開發的品種
在國內近年一致性評價+集采的組合拳背景下,普通仿制藥利潤大幅下降。想要繼續在心血管領域占據一席之地,除了激烈的價格戰外,也可以另辟蹊徑,開發新劑型/新制劑,憑借獨特的臨床優勢彎道超車。
√ 仿制立項建議
從仿制的角度考慮,如果仿制美國上市的改良型新藥中的新劑型/新制劑,由于大多數原劑型/制劑已在中國上市,新劑型/新制劑與原產品生物等效,因此大部分產品可以豁免驗證性臨床試驗;另外,上述新劑型/新制劑產品中的口服溶液制劑可以豁免BE試驗,因此僅開展藥學研究即可申報上市,大大降低開發成本。
另外,該領域的較多品種均納入了《國家鼓勵研發申報的兒童藥品》,例如尼莫地平(第一批)、普萘洛爾(第二批)、氨氯地平(第二批)、依那普利(第三批)、索他洛爾(第三批)、螺內酯(第三批)口服液體制劑等,建議企業可以重點關注。
綜合國內市場表現,建議關注以下有望首仿或者首家的品種,如下表4所示。
表4 建議可以關注的仿制品種
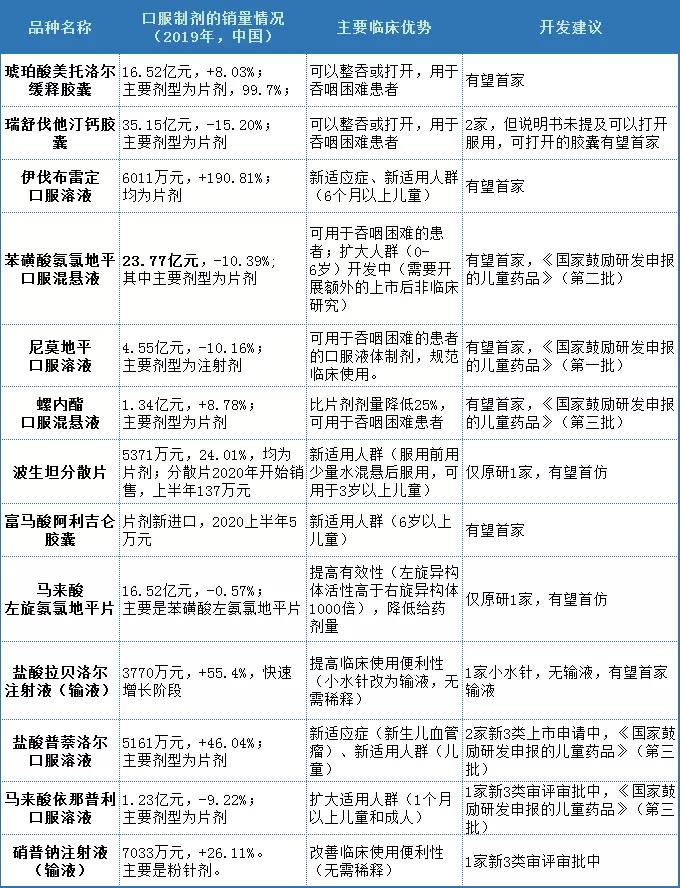
√ 改良型新藥立項建議
心血管領域歷來是市場競爭最為激烈的領域,也是很多企業的重點布局領域。從美國近10年心血管領域獲批的505(b)(2)品種來看,主要有以下改良趨勢:
口服制劑:大多數新劑型、新制劑的品種以關注特殊人群的用藥需求為主(包括吞咽困難人群和兒童用藥);這其中,不乏對大品種的改良,例如氨氯地平、瑞舒伐他汀鈣等。
注射劑:主要改良趨勢為改善臨床使用的便利性,改良型品種較少。
對于其他品種,也可以進行相似的改良型新藥設計。
此外,由于心血管類疾病主要是老年疾病,大多數患者合并高血脂、高血壓等多種疾病,開發復方制劑一方面可以發揮協同作用,另外也有助于減少用藥負擔,提高患者的依從性。
從開發成本角度考慮,新劑型與新制劑大多數未開展新的非臨床研究,臨床研究部分僅開展生物等效性試驗。相對于創新藥的開發,成本大大降低,開發成功率較高,值得進一步的深入探索。
-END-
關于我們:
綜合信息部由20名成員組成,其中總監1名、經理2名、副經理1名、主管1名、藥理專員15名,均來自北京大學、中國醫學科學院北京協和醫學院等國內外知名院校。
綜合信息部主要負責公司的國際/國內項目立項、品種市場信息支持、公司知識產權維護及撰寫臨床/藥理相關申報材料,為公司研發提供信息保障。
部門下設5個中心,其中仿創藥立項策略中心主要負責仿制藥、創新藥品種立項;臨床&藥理中心負責相關申報材料撰寫;知識產權中心負責公司知識產權維護;大數據分析中心負責國內外品種信息分析、企業產品管線規劃及戰略合作伙伴個性化信息支持;國際新產品策略中心關注國際原料藥、裝置、制劑品種信息,提供中美、中歐雙報立項信息。


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
